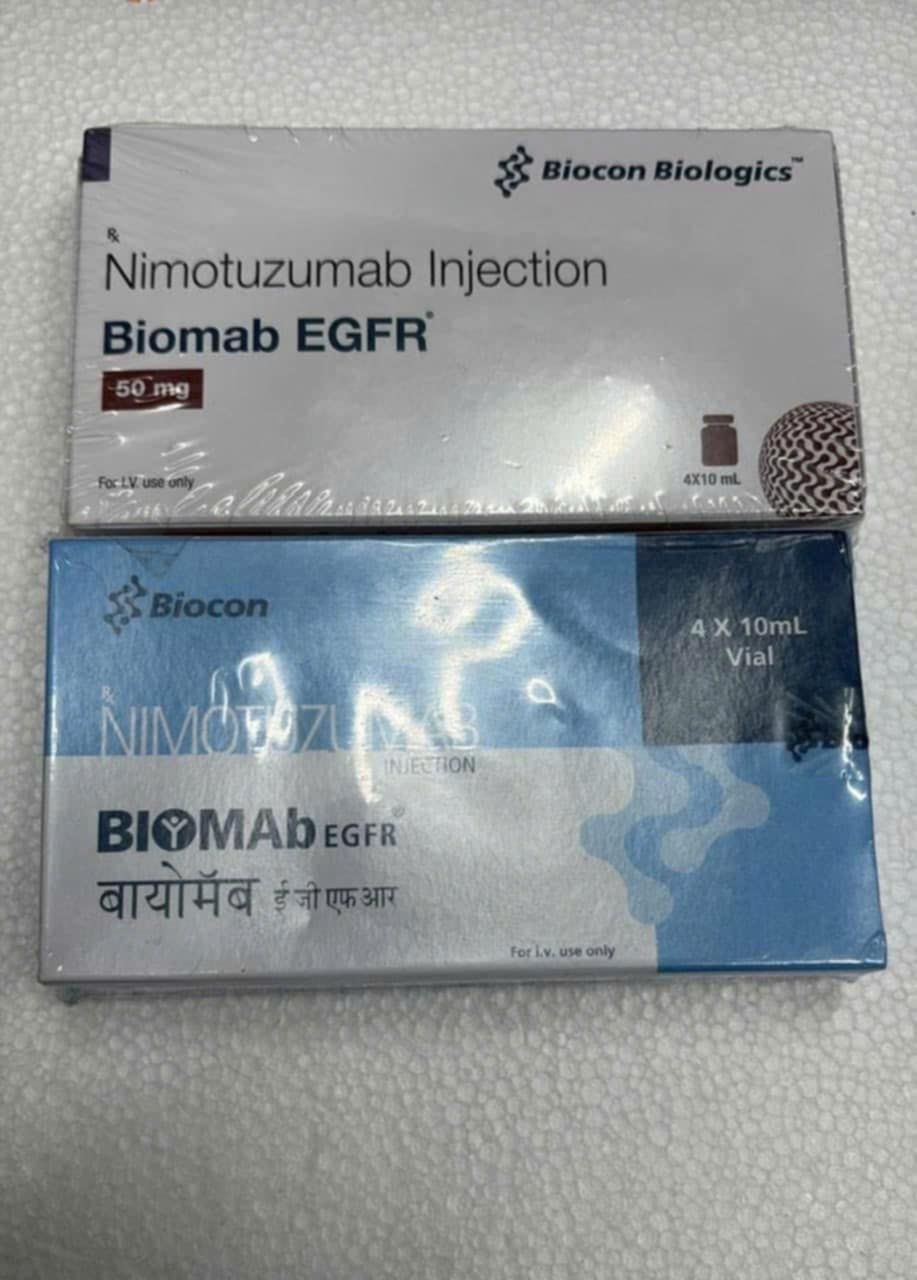
Thuốc Biomab EGFR Nimotuzumab là thuốc gì?
Thuốc Biomab EGFR Nimotuzumab là một kháng thể đơn dòng người hóa tái tổ hợp liên kết đặc hiệu với miền ngoại bào của thụ thể yếu tố tăng trưởng biểu bì người (EGFR) bằng cách tương tác với epitope nằm trong miền ngoại bào của thụ thể này. Nimotuzumab là một dạng người hóa của kháng thể đơn dòng murine IgG2a R3 (ior egf/r3). Kháng thể Nimotuzumab IgG1 người hóa được thu nhận bằng cách nhân bản các CDR của kháng thể murine vào Frs người (Eu cho chuỗi nặng và REI cho chuỗi nhẹ) và tái giới thiệu 3 dư lượng murine vào Frs người của chuỗi nặng.
Sản phẩm được pha chế dưới dạng dung dịch trong suốt và không màu, không có các chất không hòa tan.
Thuốc Biomab EGFR Nimotuzumab liên kết với miền ngoại bào của thụ thể yếu tố tăng trưởng biểu bì (EGFR, HER1, c-ErB1) và ức chế sự liên kết của yếu tố tăng trưởng biểu bì (EGF) và các ligand khác như yếu tố tăng trưởng chuyển dạng alfa. Các đặc tính nội tại của Nimotuzumab yêu cầu liên kết hai giá (tức là, liên kết với cả hai tay kháng thể đến hai mục tiêu đồng thời) để gắn kết ổn định với bề mặt tế bào, dẫn đến việc Nimotuzumab liên kết chọn lọc với các tế bào biểu hiện mức EGFR trung bình đến cao. EGFR là một glycoprotein xuyên màng là thành viên của một gia đình các thụ thể được gọi là HER. EGFR được biểu hiện trong các tế bào từ cả ba lớp phôi, đặc biệt là trong các tế bào có nguồn gốc biểu mô (da, đường hô hấp, đường tiêu hóa, đường tiết niệu và gan). Trong sự đa dạng rộng lớn của các khối u người có nguồn gốc biểu mô như ung thư đầu và cổ (SCCHN), ung thư phổi không tế bào nhỏ (NSCLC), ung thư tụy, đại tràng, vú, thận, buồng trứng và bàng quang, EGFR được biểu hiện quá mức. Nó cũng được biểu hiện quá mức trong gliomas. Sự liên kết của Nimotuzumab với EGFR chặn phosphorylation và kích hoạt các kinase liên kết với thụ thể, dẫn đến ức chế sự phát triển tế bào, kích thích apoptosis và giảm sản xuất yếu tố tăng trưởng nội mạch. Các nghiên cứu in vitro sử dụng các dòng tế bào khối u như A431, MDA-MB-435, U87 và các nghiên cứu in vivo trên chuột SCID cấy ghép khối u người đã cho thấy rằng Nimotuzumab có hoạt tính chống tăng sinh, chống angiogenic và proapoptotic.
Thuốc Biomab EGFR Nimotuzumab chỉ đinh cho bệnh nhân nào?
Thuốc Nimotuzumab được sử dụng kết hợp với hóa trị liệu hoặc xạ trị đồng thời thể hiện dược động học phi tuyến. Sau khi truyền 30 phút, diện tích dưới đường cong nồng độ theo thời gian (AUC) tăng theo cách không tỷ lệ với liều khi liều tăng từ 50 đến 400 mg. Sự thanh thải của Nimotuzumab (CL) giảm từ 1.08 xuống 0.34 mL/h/kg khi liều tăng từ 50 đến 200, và ở các liều >200 mg, nó có vẻ như đạt đến mức ổn định. Thể tích của khoang trung tâm (Vc) cho Nimotuzumab dao động từ 2.3 đến 7.2L và nồng độ tối đa Cmax là 27 đến 57 ng/mL cho cùng một khoảng liều. Thời gian bán hủy (t 1/2 ß) dao động từ 62.91 đến 304.51 giờ cho các liều 50 đến 400mg. Trong cơ thể người, Nimotuzumab chủ yếu phân bố ở gan, lách, tim, thận và bàng quang. Gan hấp thụ hầu hết Nimotuzumab. Bằng chứng từ nghiên cứu dược động học trên động vật cho thấy nồng độ của kháng thể trong khối u cao nhất sau 24 giờ tiêm.
Tính hiệu quả và an toàn của Nimotuzumab kết hợp với hóa trị liệu và/hoặc xạ trị đã được nghiên cứu trong hai thử nghiệm lâm sàng ngẫu nhiên có đối chứng (RCT) (229 bệnh nhân) và hai thử nghiệm lâm sàng không ngẫu nhiên (53 bệnh nhân). Dữ liệu an toàn từ tất cả các bệnh nhân này cũng đã được đánh giá.
Một thử nghiệm lâm sàng đa trung tâm giai đoạn II ngẫu nhiên đã tuyển 92 bệnh nhân để nghiên cứu việc bổ sung Nimotuzumab vào hai phác đồ điều trị tiêu chuẩn là xạ trị (RT) và hóa trị liệu (CT) + RT trong quản lý ung thư đầu và cổ giai đoạn III & giai đoạn IVA không thể phẫu thuật. Hai nhóm được ghép đều về tuổi, giới tính, giai đoạn khối u và KPS cơ bản mà không có sự khác biệt thống kê giữa các nhóm. Bệnh nhân nhận Nimotuzumab dưới dạng truyền tĩnh mạch 200 mg hàng tuần một lần trong 6 tuần. Phản ứng với điều trị được đánh giá vào cuối 3 tháng và 6 tháng. Tổng cộng mười sáu bệnh nhân không thể đánh giá. 76 bệnh nhân có thể đánh giá cho phân tích hiệu quả. Tỷ lệ phản ứng mục tiêu (ORR) trong các nhóm điều trị khác nhau là: Nimotuzumab không làm xấu đi KPS của bệnh nhân khi được bổ sung vào CT+RT và RT. Nimotuzumab khi được sử dụng đồng thời với CT và/hoặc RT cho thấy tỷ lệ phản ứng mục tiêu lớn hơn so với các nhóm điều trị đối chứng. Tại thời điểm theo dõi 30 tháng, tỷ lệ sống sót trong nhóm Nimotuzumab cộng với hóa xạ trị là 69.5% so với 21.7% trong nhóm hóa xạ trị đơn thuần và trong nhóm Nimotuzumab cộng với xạ trị là 39.1% so với 21.7% trong nhóm xạ trị đơn thuần. Việc bổ sung Nimotuzumab vào hóa xạ trị dẫn đến giảm nguy cơ tử vong (rrd) 85% (HR 0.15, p-0.0006) và đối với RT là 36% rrd (HR0.64, p 0.33) (OS theo giao thức).
♦ Nimotuzumab +CT+ RT so với CT+RT
54 bệnh nhân cho thấy ORR của 76 có thể đánh giá cho phân tích
Trong một thử nghiệm lâm sàng ngẫu nhiên, mở, đa trung tâm giai đoạn II ở bệnh nhân mắc ung thư biểu mô vòm họng tiến triển tại chỗ (giai đoạn III hoặc IVA-B), 137 bệnh nhân đã được bao gồm, trong đó 70 ở nhóm thuốc nghiên cứu (Nimotuzumab) và 67 ở nhóm đối chứng. Bệnh nhân trong nhóm thuốc nghiên cứu nhận Nimotuzumab kết hợp với xạ trị triệt để, trong khi nhóm đối chứng nhận xạ trị đơn thuần. Bệnh nhân nhận 8 lần truyền Nimotuzumab hàng tuần với liều 100 mg kết hợp với xạ trị. Lần truyền đầu tiên được thực hiện vào cùng ngày bệnh nhân bắt đầu xạ trị và kết thúc đồng thời với xạ trị. Phân tích được thực hiện vào cuối điều trị, 5 và 17 tuần sau điều trị riêng biệt. Khi kết thúc điều trị, tỷ lệ CR (Remission hoàn toàn) của nhóm thuốc nghiên cứu là: 76.56% cho khối u nguyên phát, 75.00% cho hạch bạch huyết, và 65.63% cho đánh giá tổng thể; so với nhóm đối chứng là 34.85%, 57.58%, và 27.27% tương ứng. Tỷ lệ CR trong nhóm thuốc nghiên cứu cao hơn so với nhóm đối chứng. 5 tuần sau điều trị, tỷ lệ CR trong nhóm thuốc nghiên cứu là 90.63% cho khối u tại chỗ, 89.06% cho hạch bạch huyết, và 87.50% cho đánh giá tổng thể; so với nhóm đối chứng là 51.52%, 72.73%, và 42.42% tương ứng. 17 tuần sau điều trị, tỷ lệ CR trong nhóm thuốc nghiên cứu là 92.19% cho khối u tại chỗ, 93.75% cho hạch bạch huyết, và 90.63% cho đánh giá tổng thể, so với 63.64%, 80.30%, và 51.52% trong nhóm đối chứng. Tất cả các sự khác biệt đều có ý nghĩa thống kê. Phản ứng mục tiêu quan sát được sau 17 tuần điều trị là 100% trong nhóm thuốc nghiên cứu và 90.91% trong nhóm đối chứng. Sự khác biệt là có ý nghĩa thống kê. Giá trị trung bình của điểm số Karnofsky của nhóm thuốc nghiên cứu sau điều trị cao hơn so với nhóm đối chứng, điều này có ý nghĩa thống kê, cho thấy rằng kháng thể có lợi trong việc cải thiện chất lượng cuộc sống của bệnh nhân. Các sự khác biệt giữa trọng lượng cơ thể của bệnh nhân trước và sau điều trị đã được phân tích và giá trị trung bình của nhóm thử nghiệm là 0.35 kg và của nhóm đối chứng là 0.87 kg và sự khác biệt này có ý nghĩa thống kê.
Một thử nghiệm lâm sàng giai đoạn I/II mở, không ngẫu nhiên tại một trung tâm được thiết kế để đánh giá an toàn và hiệu quả của Nimotuzumab kết hợp với xạ trị chùm tia bên ngoài ở 12 bệnh nhân ung thư đầu và cổ biểu hiện EGF-R tiến triển (Giai đoạn III hoặc IV) phù hợp với xạ trị triệt để. Bốn nhóm điều trị khác nhau với 3 bệnh nhân đã được thiết lập. Liều đơn trong 4 nhóm xác định từ 50 đến 400 mg Nimotuzumab. Bệnh nhân nhận cùng một liều hàng tuần trong 6 tuần. Đối với 4 nhóm, tổng liều tích lũy Nimotuzumab là 300, 600, 1200, và 2400 mg. Bệnh nhân cũng nhận 60 hoặc 66 Gy xạ trị tùy thuộc vào phản ứng từ nguồn Co 60 với liều 2Gy được cho hàng ngày trong năm ngày trong sáu tuần. Sau khi hoàn thành việc tuyển chọn, giao thức đã được sửa đổi để bao gồm năm bệnh nhân mới trong hai nhóm liều cao nhất để đánh giá thêm mối quan hệ giữa phản ứng chống khối u và nồng độ kháng thể trong huyết thanh. Trong phần thử nghiệm đầu tiên, nơi 12 bệnh nhân nhận 4 mức liều Nimotuzumab, 7 bệnh nhân trong số 12 cho thấy ORR (PR hoặc CR), và bốn đối tượng cho thấy bệnh ổn định và có sự tiến triển khối u trong 1 trường hợp sau liệu pháp kết hợp. Trong 6 trong số 7 bệnh nhân đáp ứng, có sự thuyên giảm hoàn toàn của khối u nguyên phát và di căn của nó trong khi 1 bệnh nhân cho thấy phản ứng một phần. Phân tích dược động học sơ bộ cho thấy rằng sự bão hòa thụ thể đạt được trên 200 mg. Tỷ lệ sống sót tổng thể tăng đáng kể sau khi sử dụng liều 200 hoặc 400 mg so với các liều thấp hơn (P=0.03). Với thời gian theo dõi trung bình từ khi bắt đầu điều trị đến ngày kết thúc là 45.2 tháng (phạm vi, 41.5 đến 48.1 tháng), thời gian sống trung bình cho bệnh nhân điều trị 50 và 100 mg là 8.60 tháng, trong khi thời gian sống trung bình của bệnh nhân nhận 200 và 400 mg là 44.30 tháng. Tỷ lệ sống sót 3 năm là 16.7% cho các đối tượng điều trị với hai liều thấp nhất và 66.7% cho các bệnh nhân điều trị với 200 và 400 mg. Sau khi giao thức được sửa đổi để bao gồm 10 bệnh nhân mới trong các nhóm 200 và 400 mg, cuối cùng, 14 (87.5%) trong số 16 bệnh nhân đạt được ORR trong đó 11 là CR. Thời gian sống trung bình là 22 tháng; 8 bệnh nhân còn sống và bảy người không có bệnh.
Một nghiên cứu không ngẫu nhiên đa trung tâm khác đánh giá an toàn và hiệu quả của Nimotuzumab kết hợp với xạ trị (RT) trong điều trị bệnh nhân mắc ung thư biểu mô tế bào vảy đầu và cổ (SCCHN) tiến triển tại chỗ, không thể phẫu thuật đã được thực hiện trên ba mươi một đối tượng. Bệnh nhân được điều trị bằng xạ trị 6600 hoặc 7000 cGy trong 33 hoặc 35 phân đoạn cộng với liều 100 hoặc 200 mg Nimotuzumab một lần mỗi tuần trong 6 tuần. Dân số ITT được định nghĩa là tất cả bệnh nhân nhận ít nhất một liều Nimotuzumab. Dân số có thể đánh giá được định nghĩa là tất cả bệnh nhân nhận sáu liều Nimotuzumab và đạt được đánh giá tuần 12. Hai mươi bốn bệnh nhân đã hoàn toàn có thể đánh giá. Trong số đó, 17 (70%) cho thấy phản ứng khối u hoàn toàn là phản ứng tốt nhất của họ. Tổng cộng, mười ba bệnh nhân hoàn thành nghiên cứu với tư cách là người đáp ứng hoàn toàn. Trong số các bệnh nhân có thể đánh giá còn lại, 3 (12.5%) bệnh nhân đạt được phản ứng một phần và sau đó tiến triển ở tuần 24, 1 (4.9%) bệnh nhân có bệnh ổn định trong 3 lần thăm khám và sau đó tiến triển. 3 (12.5%) bệnh nhân còn lại có bệnh tiến triển. Thời gian sống trung bình trong dân số ITT là 829 ngày. Thời gian sống trung bình của dân số có thể đánh giá hiện tại là 43.4 tháng.
Nimotuzumab được chỉ định sử dụng trong điều trị ung thư biểu mô tế bào vảy tiến triển vùng đầu và cổ với hóa trị liệu và/hoặc xạ trị đồng thời.
Thuốc Biomab EGFR Nimotuzumab được sử dụng thế nào?
Nimotuzumab được tiêm truyền tĩnh mạch liên tục (IV) với liều hàng tuần 200 mg trong 6 tuần, kết hợp với xạ trị và/hoặc hóa trị liệu tiêu chuẩn cho các bệnh ung thư đầu và cổ. 200 mg kháng thể được pha loãng trong 250 ml natri chloride và truyền trong 60 phút. Trong quá trình pha loãng với dung dịch muối sinh lý, đảm bảo rằng tất cả các biện pháp phòng ngừa được thực hiện để tránh ô nhiễm ngẫu nhiên. Trong trường hợp có bất kỳ sự đục nào được nhìn thấy trong dung dịch, điều này là do ô nhiễm vi sinh vật ngẫu nhiên. Trong trường hợp như vậy, vui lòng loại bỏ dung dịch và chuẩn bị một dung dịch mới.
Trong một thử nghiệm lâm sàng ngẫu nhiên ở bệnh nhân mắc ung thư đầu và cổ, nơi Nimotuzumab được sử dụng đồng thời với hoặc không có RT và/hoặc CT, các sự kiện bất lợi thường được báo cáo trong nhóm xạ trị là sốt.
Phản ứng chống thể kháng thể thấp
Phản ứng chống thể kháng thể thấp là dấu hiệu của tính chất nhân hóa của kháng thể và cũng có thể chịu trách nhiệm cho phản ứng quá mẫn thấp. Sự phát triển của phản ứng miễn dịch phụ thuộc vào một số yếu tố như thời gian thu thập mẫu, xử lý mẫu, thời gian thu thập, bệnh nền và thuốc đồng thời. Tỷ lệ phát triển kháng thể đối với Nimotuzumab không kết luận.
Sử dụng trong thai kỳ và cho con bú
Sử dụng trong Thai kỳ
Các nghiên cứu sinh sản động vật chưa được thực hiện với Nimotuzumab. Tuy nhiên, EGFR đã được liên quan đến việc kiểm soát sự phát triển trước sinh và do đó có thể cần thiết cho sự hình thành cơ quan bình thường, sự phát triển và phân hóa trong phôi đang phát triển. IgG1 của người được biết là có thể vượt qua hàng rào nhau thai; do đó, kháng thể có khả năng được truyền từ mẹ sang thai nhi đang phát triển. Nhưng không biết liệu kháng thể có thể gây hại cho thai nhi khi được tiêm cho phụ nữ mang thai hay không. Kháng thể chỉ nên được cho phụ nữ mang thai, hoặc bất kỳ phụ nữ nào không sử dụng biện pháp tránh thai đầy đủ nếu lợi ích tiềm năng vượt trội hơn rủi ro tiềm năng cho thai nhi. Nếu bệnh nhân mang thai trong khi nhận thuốc này, cô ấy nên được thông báo về nguy cơ tiềm tàng cho thai nhi và/hoặc nguy cơ tiềm tàng mất thai.
Sử dụng trong Cho con bú
Không biết liệu kháng thể có được tiết ra trong sữa mẹ hay không. Vì IgG1 của người được tiết ra trong sữa mẹ, khả năng hấp thụ và gây hại cho trẻ sơ sinh sau khi tiêu thụ là không rõ. Không có khuyến nghị nào được đưa ra về lợi ích tiềm năng so với rủi ro của việc tiêm Nimotuzumab cho các bà mẹ đang cho con bú.
Sử dụng ở Trẻ em
Các nghiên cứu lâm sàng hiện đang diễn ra trên bệnh nhân nhi có khối u thần kinh mà không có sự kiện bất lợi đáng kể liên quan đến Nimotuzumab. Hiệu quả trong các khối u glioma độ cao tái phát đã được điều trị nhiều lần ở trẻ em và thanh thiếu niên đã được chứng minh trong một nghiên cứu giai đoạn II. Việc áp dụng Nimotuzumab lặp đi lặp lại như liệu pháp đơn trị liệu được dung nạp tốt và an toàn. Không có sự kiện bất lợi nghiêm trọng nào được coi là liên quan đến thuốc nghiên cứu. Sự suy giảm lâm sàng chủ yếu liên quan đến các biến chứng của bệnh u, sự tiến triển của khối u hoặc, hiếm khi, với một bệnh đồng thời khác. Đặc biệt không có phản ứng dị ứng hoặc độc tính da liễu hoặc tiêu hóa nghiêm trọng nào được quan sát. Không có mối lo ngại về an toàn nào phát sinh từ các xét nghiệm trong phòng thí nghiệm, dấu hiệu sinh tồn hoặc kết quả khám lâm sàng. Không có tác dụng phụ huyết học hoặc không huyết học nghiêm trọng nào liên quan đến kháng thể Nimotuzumab được thấy, giảm thiểu nguy cơ nhiễm trùng nghiêm trọng, truyền máu và nhập viện.
Sử dụng ở Người cao tuổi
Giới hạn tuổi tối đa được đánh giá trong các nghiên cứu lâm sàng về ung thư đầu và cổ là 78 tuổi. Các nghiên cứu lâm sàng được thực hiện với Nimotuzumab không đủ để cho thấy bất kỳ sự khác biệt nào trong phản ứng do ảnh hưởng của tuổi tác cao.
Quá liều
Đã được chứng minh trong các thử nghiệm lâm sàng hoàn thành rằng liều lên đến 400 mg là an toàn cho con người. Hiện tại không có kết luận nào về độ an toàn cho các liều trên 400 mg.
Đóng gói
Có sẵn dưới dạng hộp đơn gồm 4 lọ và mỗi lọ 10mL (50 mg Nimotuzumab).
Độ ổn định và Bảo quản
BIOMab EGFRTM (Nimotuzumab) nên được bảo quản trong tủ lạnh ở nhiệt độ từ 2°C đến 8°C. Không được đông lạnh. Việc đông lạnh và rã đông sẽ phá hủy hoạt tính sinh học của Nimotuzumab. Nimotuzumab được pha loãng trong dung dịch natri clorua ổn định về mặt vật lý và hóa học trong 12 giờ ở 2~8 oC, và trong 6 giờ ở nhiệt độ phòng (25 ± 3°C). Nimotuzumab có thể không hoạt động trong dung dịch đã chuẩn bị ngoài các điều kiện này, dung dịch nên được loại bỏ và dung dịch mới được chuẩn bị để tiêm.
Thời gian sử dụng
24 tháng.
Thuốc Biomab EGFR Nimotuzumab giá bao nhiêu?
Tư vấn: 0778718459
Thuốc Biomab EGFR Nimotuzumab mua ở đâu?
- Hà Nội: 80 Vũ Trọng Phụng, Thanh Xuân
- HCM: 152 Lạc Long Quân, phường 3, quận 11